Состояние системы, стандартное состояние. Состояние системы Задачи химической термодинамики
Системный подход в моделировании
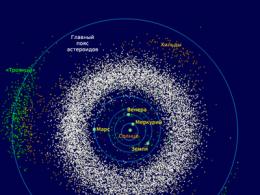
Понятие о системе. Окружающий нас мир состоит из множества различных объектов, каждый из которых имеет разнообразные свойства, и при этом объекты взаимодействуют между собой. Например, такие объекты, как планеты нашей Солнечной системы, имеют различные свойства (массу, геометрические размеры и пр.) и по закону всемирного тяготения взаимодействуют с Солнцем и друг с другом.
Планеты входят в состав более крупного объекта - Солнечной системы, а Солнечная система - в состав нашей галактики "Млечный путь". С другой стороны, планеты состоят из атомов различных химических элементов, а атомы - из элементарных частиц. Можно сделать вывод, что практически каждый объект состоит из других объектов, то есть представляет собой систему .
Важным признаком системы является ее целостное функционирование . Система является не набором отдельных элементов, а совокупностью взаимосвязанных элементов. Например, компьютер является системой, состоящей из различных устройств, при этом устройства связаны между собой и аппаратно (физически подключены друг к другу) и функционально (между устройствами происходит обмен информацией).
Система является совокупностью взаимосвязанных объектов, которые называются элементами системы.
Состояние системы характеризуется ее структурой, то есть составом и свойствами элементов, их отношениями и связями между собой. Система сохраняет свою целостность под воздействием различных внешних воздействий и внутренних изменений до тех пор, пока она сохраняет неизменной свою структуру. Если структура системы меняется (например, удаляется один из элементов), то система может перестать функционировать как целое. Так, если удалить одно из устройств компьютера (например, процессор), компьютер выйдет из строя, то есть прекратит свое существование как система.
Статические информационные модели. Любая система существует в пространстве и во времени. В каждый момент времени система находится в определенном состоянии, которое характеризуется составом элементов, значениями их свойств, величиной и характером взаимодействия между элементами и так далее.
Так, состояние Солнечной системы в любой момент времени характеризуется составом входящих в нее объектов (Солнце, планеты и др.), их свойствами (размерами, положением в пространстве и др.), величиной и характером взаимодействия между собой (силами тяготения, с помощью электромагнитных волн и др.).
Модели, описывающие состояние системы в определенный момент времени, называются статическими информационными моделями .
В физике примером статических информационных моделей являются модели, описывающие простые механизмы, в биологии - модели строения растений и животных, в химии - модели строения молекул и кристаллических решеток и так далее.
Динамические информационные модели. Состояние систем изменяется во времени, то есть происходят процессы изменения и развития систем . Так, планеты движутся, изменяется их положение относительно Солнца и друг друга; Солнце, как и любая другая звезда, развивается, меняются ее химический состав, излучение и так далее.
Модели, описывающие процессы изменения и развития систем, называются динамическими информационными моделями .
В физике динамические информационные модели описывают движение тел, в биологии - развитие организмов или популяций животных, в химии - процессы прохождения химических реакций и так далее.
Вопросы для размышления
1. Образуют ли систему комплектующие компьютера: До сборки? После сборки? После включения компьютера?
2. В чем разница между статическими и динамическими информационными моделями? Приведите примеры статических и динамических информационных моделей.
Биомедицинская значимость темы
Термодинамика представляет собой раздел физической химии, изучающий любые макроскопические системы, изменения состояния которых связано с передачей энергии в форме теплоты и работы.
Химическая термодинамика является теоретической основой биоэнергетики – науки о превращениях энергии в живых организмах и специфических особенностях превращения одних видов энергии в другие в процессе жизнедеятельности. В живом организме существует тесная взаимосвязь между процессами обмена веществ и энергии. Обмен веществ является источником энергии всех жизненных процессов. Осуществление любых физиологических функций (движение, поддержание постоянства температуры тела, выделение пищеварительных соков, синтез в организме различных сложных веществ из более простых и т.п.) требует затраты энергии. Источником всех видов энергии в организме являются питательные вещества (белки, жиры, углеводы), потенциальная химическая энергия которых в процессе обмена веществ превращается в другие виды энергии. Основным путем освобождения химической энергии, необходимой для поддержания жизнедеятельности организма и осуществления физиологических функций, являются окислительные процессы.
Химическая термодинамика позволяет установить связь между энергетическими затратами при выполнении человеком определенной работы и калорийностью питательных веществ, дает возможность понять энергетическую сущность биосинтетических процессов, протекающих за счет энергии, высвобождаемой при окислении питательных веществ.
Знание стандартных термодинамических величин относительно небольшого числа соединений позволяет производить термохимические расчеты для энергетической характеристики различных биохимических процессов.
Применение термодинамических методов дает возможность количественно оценить энергетику структурных превращений белков, нуклеиновых кислот, липидов и биологических мембран.
В практической деятельности врача термодинамические методы наиболее широко используются для определения интенсивности основного обмена при различных физиологических и патологических состояниях организма, а также для определения калорийности пищевых продуктов.
Задачи химической термодинамики
1. Определение энергетических эффектов химических и физико–химических процессов.
2. Установление критериев самопроизвольного протекания химических и физико–химических процессов.
3. Установление критериев равновесного состояния термодинамических систем.
Основные понятия и определения
Термодинамическая система
Тело или группа тел, отделенных от окружающей среды реальной или воображаемой поверхностью раздела, называют термодинамической системой.
В зависимости от способности системы обмениваться с окружающей средой энергией и веществом различают изолированные, закрытые и открытые системы.
Изолированной системой называют систему, которая не обменивается с окружающей средой ни веществом, ни энергией.
Систему, которая обменивается с окружающей средой энергией и не обменивается веществом, называют закрытой .
Открытой системой называют систему, обменивающуюся с окружающей средой и веществом, и энергией.
Состояние системы, стандартное состояние
Состояние системы определяется совокупностью ее физических и химических свойств. Каждое состояние системы характеризуется определенными величинами этих свойств. Если эти свойства изменяются, то изменяется и состояние системы, если же свойства системы не изменяются со временем, то система находится в состоянии равновесия.
Для сравнения свойств термодинамических систем необходимо точно указать их состояние. С этой целью введено понятие – стандартное состояние, за которое для индивидуальной жидкости или твердого тела принимается такое физическое состояние, в котором они существуют при давлении в 1 атм (101315 Па) и данной температуре.
Для газов и паров стандартное состояние отвечает гипотетическому состоянию, в котором газ при давлении в 1 атм подчиняется законам идеальных газов, при данной температуре.
Величины, относящиеся к стандартному состоянию, пишутся с индексом «о» и нижним индексом указывается температура, чаще всего это 298К.
Уравнение состояния
Уравнение, устанавливающее функциональную зависимость между величинами свойств, определяющих состояние системы, называют уравнением состояния.
Если известно уравнение состояния системы, то для описания ее состояния не обязательно знать численные значения всех свойств системы. Так, например, уравнение Клапейрона–Менделеева является уравнением состояния идеального газа:
где Р – давление, V – объем, n – число молей идеального газа, Т – его абсолютная температура и R– универсальная газовая постоянная.
Из уравнения следует, что для определения состояния идеального газа достаточно знать численные значения любых трех из четырех величин Р,V,n,T.
Функции состояния
Свойства, величины которых при переходе системы из одного состояния в другое зависят только от начального и конечного состояния системы и не зависят от пути перехода, получили название функций состояния. К ним относятся, например, давление, объем, температура системы.
Процессы
Переход системы из одного состояния в другое называют процессом. В зависимости от условий протекания различают следующие виды процессов.
Круговой или циклический – процесс, в результате протекания которого, система возвращается в исходное состояние. По завершении кругового процесса изменения любой функции состояния системы равны нулю.
Изотермический – процесс, протекающий при постоянной температуре.
Изобарный – процесс, протекающий при постоянном давлении.
Изохорный – процесс, при котором объем системы остается постоянным.
Адиабатический – процесс, происходящий без теплообмена с окружающей средой.
Равновесный – процесс, рассматриваемый как непрерывный ряд равновесных состояний системы.
Неравновесный – процесс, при котором система проходит через неравновесные состояния.
Обратимый термодинамический процесс – процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние.
Необратимый термодинамический процесс – процесс, после которого система и взаимодействующие с ней системы (окружающая среда) не могут возвратиться в начальное состояние.
Более подробно последние понятия рассмотрены в разделе «Термодинамика химического равновесия».
| Наименование параметра | Значение |
| Тема статьи: | Состояние системы |
| Рубрика (тематическая категория) | Образование |
Определение 1.6 Состоянием системы называют совокупность параметров, которые в каждый рассматриваемый момент времени отражают наиболее существенные с определенной точки зрения стороны поведения системы, ее функционирования.
Определение является весьма общим. В нем подчеркивается, что выбор характеристик состояния зависит от целей исследования. В простейших случаях состояние может оцениваться одним параметром, способным принимать два значения (включено или выключено, 0 или 1). В более сложных исследованиях приходится учитывать множество параметров, способных принимать большое число значений.
Система, состояние которой изменяется во времени под воздействием определенных причинно-следственных связей, принято называть динамической системой, в отличие от статической системы, состояние которой во времени не изменяется.
Желаемое состояние системы достигается или поддерживается соответствующими управляющими воздействиями.
Управление
В кибернетике управление воспринимается как процесс целенаправленного изменения состояния системы. Иногда управлением называют процесс переработки воспринятой информации в сигналы, направляющие деятельность машин и организмов. А процессы восприятия информации, ее хранения, передачи и воспроизведения относят к области связи. Существует и более широкая трактовка понятия управления, включающая все элементы управленческой деятельности, объединенные единством цели, общностью решаемых задач.
Определение 1.7 Управлением принято называть информационный процесс подготовки и сопровождения целенаправленного воздействия на объекты и процессы реального мира.
Такая трактовка охватывает все вопросы, которые приходится решать управляющему органу, от сбора информации, системного анализа, выработки решений, планирования мероприятий по реализации решений и до формирования управляющих сигналов и доведения их до исполнительных органов.
Состояние системы - понятие и виды. Классификация и особенности категории "Состояние системы" 2017, 2018.
Понятие внешней среды Система существует среди других материальных объектов, которые не вошли в нее. Они объединяются понятием "внешняя среда" - объекты внешней среды. Внешняя среда- это набор существующих в пространстве и во времени объектов (систем), которые,... .[читать подробнее] .
Состояние системы . Неравновесное состояние системы характеризуется различными значениями ее параметров в каждой точке системы.
Равновесным считают такое состояние системы, при котором во всех ее точках параметры системы имеют одинаковые неизменные во времени значения.
Если все точки системы имеют одинаковую температуру, то считается, что система находится в состоянии термического равновесия. Если давление одинаково во всех точках системы,то она находится в состоянии механического равновесия.
Опыт показывает, что система, выведенная из равновесия и не подвергающаяся больше внешним воздействиям, самостоятельно вернется в равновесное состояние. Из равновесного состояния в неравновесное система не может перейти без внешнего воздействия.
Если рабочее тело под воздействием внешних или внутренних факторов выведено из равновесия, то все параметры,характеризующие его состояние, изменяются, т.е. начнется термодинамический процесс изменения состояния рабочего тела.
Термодинамический процесс может быть наглядно представлен в виде графика на pV – диаграмме:
Допустим, что в рабочем пространстве цилиндра 1 , снабженного поршнем 2 заключена масса газа m с начальными параметрами p 1 и υ 1 (точка 1). Примем, что на поршень с внешней стороны действует постоянная сила P и газ находится в состоянии равновесия.
Для осуществления процесса необходимо нарушить равновесие системы.
Процесс, переводящий тело из одного состояния в другое, из точки 1 в точку 2 , выразится некоторой кривой 1 -2 средних значений параметров. Точки1 и 2 точно характеризуют равновесное состояние газа в начале и в конце процесса. Вид кривой зависит от характера процесса. Такую кривую называют кривой термодинамического процесса.
Внутренняя энергия системы . Кинетическую энергию микроскопических тепловых движений молекул и потенциальную энергию их взаимодействия называют внутренней энергией тела.
В любом состоянии система, изолированная от внешней среды или находящаяся во взаимодействии с ней, имеет определенное количество внутренней энергии U.
Если состояние системы изменилось в результате любого термодинамического процесса, то изменение ее внутренней энергии не зависит от того, как протекал этот процесс, а зависит только от конечного и начального состояния рабочего тела. Поэтому такое изменение внутренней энергии тела в процессе определяется разностью значений энергии в начале и конце взаимодействия тела с внешней средой
| s w:val="28"/> | (17) |
Где U 1 и U 2 – внутренняя энергии в начале и в конце процесса.
Работа и количество теплоты. Механическая работа, рассматриваемая в термодинамике, является мерой механической энергии. Она производится при перемещении тела в пространстве под действием механической силы.
Если газ, находящийся в цилиндре под поршнем, расширяется, то его объем увеличивается (d >0). При этом газ передвигает поршень,
совершая механическую работу. Такую работу считают положительной. При сжатии газа (d <0) работа производится над газом со стороны внешней среды. Эту работу считают отрицательной.
Для того чтобы вычислить механическую работу, совершаемую термодинамической системой, рассмотрим систему, представляющую собой т кг газа, находящегося в цилиндре, под поршнем (при р = const). Его состояние определяется параметрами р 1, V 1 , Т 1, что на диаграмме (рис.1) соответствует точке 1. Давление, газа p 1 уравновешено внешней силой Р, приложенной к штоку поршня. Таким образом, система находится в равновесии.
Подведем к системе теплоту Q, которая нарушит равновесное состояние газа. Газ под действием теплоты, расширяясь, будет давить на поршень с силой R, преодолевая силу Р, и передвинет его вправо на расстояние х, совершив при этом работу. Состояние газа в точке определится параметрами р 2 , V 2 и T 2 .
Совершенную газом работу можно вычислить по общим правилам механики, а можно также определить графически, изобразив ее на pV-диаграмме.
Но произведение площади F поршня на путь x представляет собой объем цилиндра между начальным и конечным положениями поршня:
| (23) |
Из формулы видно, что изменение объема газа сопровождается работой, равной произведению давления, под которым находится газ, на изменение его объема.
Теперь по конечным параметрам газа построим график на pV- диаграмме, определяющий зависимость между его объемом в цилиндре и абсолютным давлением. Диаграмма дает возможность графически оценить работу расширения газа.(рис.2)

Так как давление газа в процессе расширения принято постоянным, то линия процесса 1-2 на диаграмме параллельна оси абсцисс. Поэтому, опустив перпендикуляры из точек 1 и 2, начала и конца процесса, получим замкнутый контур в виде прямоугольника 12 3 4, образованный линией процесса 1-2, крайними ординатами 1,4 и 2,3 и отрезком оси абсцисс, равным V 2 - V 1 . Площадь диаграммы, расположенная в этом контуре, на рV-диаграмме определяет работу расширения газа. Ее легко определить умножением ее основания на высоту.
В термодинамическом процессе, где давление меняется с изменением объема (рис.3), количество работы также определяется пл.1 2 3 4, ограниченной линией процесса 1-2, осью абсцисс 4,3 и крайними ординатами 2,3 и 1,4. Однако замкнутый контур 1234 является сложной фигурой. 
Эту работу можно вычислить аналитически. Для этого разобьем весь процесс, изображенный на диаграмме кривой 1-2, на большое число бесконечно малых процессов и определим работу расширения газа одного такого элементарного процесса. В бесконечно малом изменении состояния газа изменение его параметров также бесконечно мало. Поэтому можно считать, что в пределах каждого элементарного процесса давление газа остается постоянным. Тогда по формуле (23) элементарная работа dL расширения газа при изменении объема на величину = dV равна
| d | (24) |
На рV-диаграмме элементарная работа dL изобразится в виде площади бесконечно узкого прямоугольника абвг (рис.3), величина которого определится произведением его основания на высоту р. Очевидно, кривая всего процесса 1-2 представится в виде ступенчатой кривой, составленной из элементарных процессов. Можно себе представить, что при бесконечном увеличении числа элементарных участков ступенчатая кривая превратится в плавную кривую процесса.
Полная работа расширения т кг газа в процессе 1-2 определится суммой элементарных работ. Эта сумма равна определенному интегралу, взятому в пределах от начального объема V 1 до конечного объема V 2 :
| (27) |
Количество теплоты в термодинамическом процессе является мерой тепловой энергии, подведенной к системе или отведенной от системы.
Не следует говорить о количестве теплоты, содержащейся в теле, а можно говорить лишь о том, сколько тело отдаст или получит теплоты в том или ином процессе. В отличие от внутренней энергии работа и количество теплоты зависят не только от начального и конечного состояния газа, но и от пути, по которому происходило изменение его состояния.
Количество теплоты, полученное телом, принято считать положительным, а отданное телом - отрицательным.
Количества теплоты и работы измеряются в одних и тех же единицах- в джоулях (дж).
Закон сохранения энергии устанавливает, что энергия не создается, не уничтожается и что одна форма энергии может переходить в другую; при этом превращение совершается таким образом, что определенное количество одной формы энергии переходит в равное количество другой формы энергии. Первый закон термодинамики по существу является законом сохранения энергии. Он устанавливает количественную зависимость между подводимой к системе теплотой, ее внутренней энергией и совершаемой системой работой (механической энергией).
Первый закон (начало) термодинамики формулируют так: вся теплота, подведенная к системе, расходуется на изменение внутренней энергии системы и на совершение внешней работы:
Первый закон термодинамики, устанавливая количественную зависимость между видами энергии, не указывает условий, при которых протекают преобразования одного вида энергии в другой.
Сравнивая равенства (26) и (29), можно первый закон термодинамики представить в виде
где R- газовая постоянная.
Для удобства термодинамических расчетов вводится новый параметр состояния рабочего тела-энтропия.
Рассмотрим уравнение первого закона термодинамики:
А так как из уравнения Клапейрона pv = RT следует, что
Правая часть этого уравнения представляет собой полный дифференциал некоторой функции переменных Т и V. Обозначив эту функцию через s, запишем
Энтропия так же, как и удельная теплоемкость, измеряется в Отсутствие приборов для измерения энтропии долгое время задерживало ее применение в решении технических задач. Простота и удобство применения энтропия в качестве параметра привели к широкому использованию ее в теплотехнических расчетах.
 Одним из важных вопросов теплотехники является подсчет теплоты, подведенной к двигателю и отведенной от него. По степени использования теплоты судят о работе двигателя и о его экономичности. Этот вопрос легко разрешается графическим изображением термодинамического процесса в системе координат, где по оси абсцисс откладывают значения энтропии, а по оси ординат - значения температуры. Так же, как и на pυ-диаграмме, состояния тела в каждый момент времени на Ts-диаграмме изображается точкой, процесс - линией. Теплота процесса на Ts-диаграмме определяется площадью под линией процесса.
Одним из важных вопросов теплотехники является подсчет теплоты, подведенной к двигателю и отведенной от него. По степени использования теплоты судят о работе двигателя и о его экономичности. Этот вопрос легко разрешается графическим изображением термодинамического процесса в системе координат, где по оси абсцисс откладывают значения энтропии, а по оси ординат - значения температуры. Так же, как и на pυ-диаграмме, состояния тела в каждый момент времени на Ts-диаграмме изображается точкой, процесс - линией. Теплота процесса на Ts-диаграмме определяется площадью под линией процесса.
Действительно, если линия 1-2 на Ts-диаграмме (рис.4) изображает произвольный процесс, то элементарное количество теплота процесса dq, равное Tds, численно равно площадке, имеющей высоту Т и основание ds. Вся теплота процесса численно равна пл. 12 3 4 под кривой процесса, так как
Напишем это уравнение для произвольного конечного процесса изменения состояния газа, определяемого участком любой кривой 1-2:
 | (39) |
| (40) |
то уравнение (30) можно переписать:
| (41) |
Энтальпия является одной из самых важных функций технической термодинамики.
Подставляя в уравнение первого закона термодинамики величину, найденную из уравнения (43), получим следующее выражение для первого закона термодинамики:
Отсюда следует, что количество теплоты, которое передается в процессе с постоянным давлением, можно найти как разность энтальпий в конечном и начальном состояниях процесса р = const. При этом удобно использовать имеющиеся таблицы или диаграммы газов.
Состояние. Понятием состояние обычно характеризуют мгновенную фотографию, «срез» системы, остановку в её развитии. Его определяют либо через входные воздействия и выходные сигналы (результаты), либо через свойства, параметры системы (например, давление, скорость, ускорение - для физических систем; производительность, себестоимость продукции, прибыль - для экономических систем).
Таким образом, состояние - это множество существенных свойств, которыми система обладает в данный момент времени.
Возможные состояния реальной системы образуют множество допустимых состояний системы.
Количество состояний (мощность множества состояний) может быть конечно, счетно (количество состояний измеряется дискретно, но их число бесконечно); мощности континуум (состояния изменяются непрерывно и число их бесконечно и несчетно).
Состояния можно описать через переменные состояния . Если переменные – дискретные, то количество состояний может быть либо конечным, либо счетным. Если переменные – аналоговые (непрерывные), тогда - мощности континуум.
Минимальное количество переменных, через которые может быть задано состояние, называется фазовым пространством . Изменение состояния системы отображается в фазовом пространстве фазовой траекторией .
Поведение. Если система способна переходить из одного состояния в другое (например, s 1 →s 2 →s 3 → ...), то говорят, что она обладает поведением. Этим понятием пользуются, когда неизвестны закономерности (правила) перехода из одного состояния в другое. Тогда говорят, что система обладает каким-то поведением и выясняют его характер.
Равновесие. Способность системы в отсутствии внешних возмущающих воздействий (или при постоянных воздействиях) сохранять своё состояние сколь угодно долго. Это состояние называют состоянием равновесия.
Устойчивость. Способность системы возвращаться в состояние равновесия после того, как она была из этого состояния выведена под влиянием внешних (а в системах с активными элементами – внутренних) возмущающих воздействий.
Состояние равновесия, в которое система способна возвращаться, называют устойчивым состоянием равновесия.
Развитие. Под развитием обычно понимают увеличение сложности какой-либо системы, улучшение приспособленности к внешним условиям. В результате возникает новое качество или состояние объекта.
Целесообразно выделять особый класс развивающихся (самоорганизующихся) систем, обладающих особыми свойствами и требующих использования специальных подходов к их моделированию.
Входы системы х i – это различные точки воздействия внешней среды на систему (рис. 1.3).
Входами системы могут быть информация, вещество, энергия и т.д., которые подлежат преобразованию.
Обобщённым входом (X ) называют некоторое (любое) состояние всех r входов системы, которое можно представить в виде вектора
X = (x 1 , x 2 , x 3 , …, x k , …, x r ).
Выходы системы y i – это различные точки воздействия системы на внешнюю среду (рис. 1.3).
Выход системы представляет собой результат преобразования информации, вещества и энергии.
Движение системы – это процесс последовательного изменения её состояния.
Рассмотрим зависимости состояний системы от функций (состояний) входов системы, её состояний (переходов) и выходов.
Состояние системы Z (t ) в любой момент времени t зависит от функции входов X (t ), а также от предшествующих её состояний в моменты (t – 1), (t – 2), …, т.е. от функций её состояний (переходов)
Z(t) = F c , (1)
где F c – функция состояния (переходов) системы.
Связь между функцией входа X(t ) и функцией выхода Y(t ) системы, без учёта предыдущих состояний, можно представить в виде
Y(t) = Fв [X (t )],
где F в – функция выходов системы.
Система с такой функцией выходов называется статической .
Если же выход системы зависит не только от функций входов X(t ), но и от функций состояний (переходов) Z(t – 1), Z (t – 2), ..., то
системы с такой функцией выходов называются динамическими (или системами с поведением).
В зависимости от математических свойств функций входов и выходов систем различают системы дискретные и непрерывные.
Для непрерывных систем выражения (1) и (2) выглядят как:
 (4)
(4)
Уравнение (3) определяет состояние системы и называется уравнением состояний системы.
Уравнение (4) определяет наблюдаемый выход системы и называется уравнением наблюдений.
Функции F c (функция состояний системы) и F в (функция выходов) учитывают не только текущее состояние Z (t ), но и предыдущие состояния Z (t – 1), Z (t – 2), …, Z (t – v ) системы.
Предыдущие состояния являются параметром «памяти» системы. Следовательно, величина v характеризует объём (глубину) памяти системы.
Процессы системы – это совокупность последовательных изменений состояния системы для достижения цели. К процессам системы относятся:
– входной процесс;
– выходной процесс;