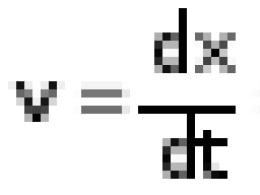Какие для алканов характерны реакции. Именные органические реакции По реакции вюрца
Именные органические реакции
В органической химии существует огромное число реакций, носящих имя исследователя, открывшего или исследовавшего данную реакцию.
Именные реакции можно найти во многих справочниках по органической химии, но я хочу разделить их по классам химических соединений. И, конечно, это далеко не все именные реакции, это те реакции, которые часто встречаются в школьном курсе органической химии.
Именные реакции :
- Реакция Вюрца — «именная» реакция удлинения цепи, а точнее, удвоение количества атомов углерода:
C2H5Cl + 2Na +Cl C2H5 → C4H10 + 2NaCl (из этана получили бутан)
- Реакция Коновалова: c разбавленной азотной кислотой под давлением алканы нитруются:
С2H6 + HNO3 (HO-NO2) → С2H5NO2 + H2O (нитроэтан)
- Еще одна «именная» реакция: реакция Кольбе: электролиз солей :
2СH3COONa -(электролиз)-→ СH3-CH3 (этан) + 2СO2 +2Na
Именные реакции :
- Присоединение по правилу Марковникова:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
С H2=C H-CH3 + H Cl = CH 3-C HCl -CH3
- Обратная реакция — дегидрирования — правило Зайцева — водород отнимается от самого ненасыщенного водородами (наименее гидрогенизированного) атома углерода.
Именные реакции :
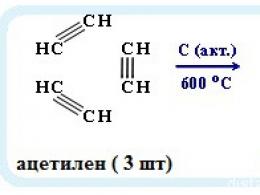
- реакция Кучерова
CH 3 -C≡CH + H 2 O -> (катализатор — Hg 2+) -> CH 3 -C(=O)-CH 3

Именные реакции
- Ту структурную формулу, которую мы сейчас используем — «скворечник», называют формулой Кекуле:

- Реакция Зинина — восстановление нитробензола и его нитрогомологов:

- Реакция Фриделя-Крафтца — алкилирование аренов:

Как это может быть применимо в ЕГЭ? Представьте себе, было как-то такое задание в части В:
Соотнесите именную реакцию или правило с той или иной реакцией или нужным правилом
1. Реакция Вюрца 1. 2CH3CH2OH → CH2=CH–CH=CH2 (+ H2; + 2H2O)
2. Реакция Кучерова 2. R–H + HNO3 → R–NO2 (+ H2O)
3. Реакция Зелинского 3. 2C2H5I + 2Na → н-C4H10 (+ 2NaI)
4. Реакция Коновалова 4. цикло-C6H12 → C6H6 (+ 3H2)
5. Реакция Зинина 5. C2H2 + H2O → CH3CHO
6. Реакция Бутлерова 6. C6H5NO2 + H2 (H+) → C6H5NH2
7. Правило Марковникова 7. CH3CH2CH(OH)CH3 → CH3CH=CHCH3 (+ H2O)
8. Правило Зайцева 8. CH3CH2CH=CH2 + HCl → CH3CH2–CHCl–CH3
Вообще, такие задания — именные реакции -редкость в ЕГЭ, но лучше знать, чем потом ломать голову над такой задачкой! Да и повторить еще раз основные органические реакции — не лишнее.
Еще на эту тему:

Вюрца реакция
метод синтеза насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды): 2RBr + 2Na → R - R + 2NaBr. B. p. открыта Ш. А. Вюрц ем. (1855). P. Фиттиг распространил В. р. на область жирно-ароматических углеводородов (реакция Вюрца - Фиттига): C 6 H 5 Br + 2Na + ВrC 4 H 9 → С 6 Н 5 - С 4 Н 9 + 2NaВr.
Большая советская энциклопедия. - М.: Советская энциклопедия . 1969-1978 .
Смотреть что такое "Вюрца реакция" в других словарях:
Конденсация алкилгалогенидов под действием Na (реже Li или К) с образованием предельных углеводородов: 2RHal + 2Na > RЧR + 2NaHal, где Hal обычно Br или I. При использовании в р ции разл. алкилгалогенидов (RHal и R Hal) образуется… … Химическая энциклопедия
- … Википедия
Реакция Вюрца, или синтез Вюрца метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или хлориды). Приводит к увеличению углеводородной цепи (суммированию углеводородных… … Википедия
Реакция Вюрца, или синтез Вюрца метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды): 2RBr + 2Na → R R + 2NaBr Реакция Вюрца открыта Ш. А. Вюрцем (1855). P.Фиттиг… … Википедия
См. Вюрца реакция … Химическая энциклопедия
Синтез орг. соединений с применением магнийорг. галогенидов RMgHal (реактивов Гриньяра). Последние обычно получают по р ции: RHal + Mg > RMgHal. При этом р р RHal в диэтиловом эфире медленно при перемешивании прибавляют к суспензии Mg в этом же р … Химическая энциклопедия
Получение эфиров b гидроксикарбоновых к т взаимод. альдегидов или кетонов с эфирами a галогенкарбоновых к т в присут. Zh (т. наз. классическая P.p.): В р цию вступают разл. альдегиды и кетоны (насыщенные или ненасыщенные, ароматические,… … Химическая энциклопедия
Эта статья о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan … Википедия
Исторически закрепившееся в органической химии название большой группы реакций образования сложных соединений из двух или нескольких более простых. К. р., различающиеся как по природе реагентов, так и по существу химических превращений,… …
Органические соединения, содержащие атом какого либо металла, непосредствнно связанный с атомом углерода. Все М. с. можно подразделить на две группы: 1. М. с. непереходных и часть М. с. переходных металлов. Эти соединения… … Большая советская энциклопедия
Книги
- Жизнь замечательных устройств , Курамшин Аркадий Искандерович , Как прославиться химику? Очень просто! В честь него могут быть названы открытая им реакция, новое вещество или даже реагент! Но если этого недостаточно, то у такого ученого есть и ещё один… Категория: Химические науки Серия: Научпоп Рунета Издатель: АСТ ,
- Жизнь замечательных устройств , Курамшин А. , Как прославиться химику? Очень просто! В честь него могут быть названы открытая им реакция, новое вещество или даже реагент! Но если этого недостаточно, то у такого ученого есть и ещё один… Категория:
2RHal + 2Na -> R-R + 2NaHal,
где Hal - обычно Br или I. При использовании в р-ции разл. алкилгалогенидов (RHal и R"Hal) образуется трудноразделяемая смесь всех возможных продуктов (R-R, R"-R", R"-R).
В. р. легко протекает, если алкилгалогенид имеет большую мол. массу, а галоген связан с первичным атомом С. Процесс проводят при низких т-рах в сольватирующих р-рителях. Так, в ТГФ реакция осуществляется быстро и с хорошим выходом уже при - 80 °С.
Предполагается, что механизм р-ции включает образование ион-радикалов
и радикалов:
Однако факт обращения конфигурации нек-рых оптически активных алкилгалогенидов (напр., 2-хлороктана в р-ции с Na) не исключает возможности гетеролитич. механизма.
реакция открыта Ш. Вюрцем в 1855 и используется главным образом для получения углеводородов с длинной углеродной цепью. В др. случаях, особенно при получении несимметричных ал-канов, применяют разл. модификации В. р., рассмотренные ниже.
Для синтеза жирноароматич. соед. используют модификацию Фиттига (р-цию Вюрца-Фиттига):
ArHal + RHal + 2Na -> Ar-R + 2NaHal
реакция открыта Р. Фиттигом в 1855. Часто с хорошим выходом образуются
алканы с использованием реактива Гриньяра, напр.:

Несимметричные предельные углеводороды получают, используя медьорг.
соед.:
Р-цию, подобную В. р., используют для синтеза элементоорг. соед. и бициклич.
соед., напр.:

Лит.: Реакции металлоорганических соединений как редокс-проиессы, М., 1981, с. 16-38. Е.Г. Тер-Габриэлям.
Полезные интернет ресурсы:
Автор Химическая энциклопедия г.р. И.Л.КнунянцВЮРЦА РЕАКЦИЯ , конденсация алкилгалогенидов под действием Na (реже - Li или К) с образованием предельных углеводородов:
2RHal + 2Na -> R-R + 2NaHal,
где Hal - обычно Br или I. При использовании в реакции различные алкилгалогенидов (RHal и R»Hal) образуется трудноразделяемая смесь всех возможных продуктов (R-R, R»-R», R»-R). ВЮРЦА РЕАКЦИЯ р. легко протекает, если алкилгалогенид имеет большую мол. массу, а галоген связан с первичным атомом С. Процесс проводят при низких температурах в сольватирующих растворителях. Так, в ТГФ реакция осуществляется быстро и с хорошим выходом уже при - 80 °С.
Предполагается, что механизм реакции включает образование ион-радикалов
и радикалов:

Однако факт обращения конфигурации некоторых оптически активных алкилгалогенидов (например, 2-хлороктана в реакции с Na) не исключает возможности гетеролитич. механизма.
Реакция открыта Ш. Вюрцем в 1855 и используется главным образом для получения углеводородов с длинной углеродной цепью. В др. случаях, особенно при получении несимметричных ал-канов, применяют различные модификации ВЮРЦА РЕАКЦИЯ р., рассмотренные ниже.
Для синтеза жирноароматические соединение используют модификацию Фиттига (реакцию Вюрца-Фиттига):
ArHal + RHal + 2Na -> Ar-R + 2NaHal
Реакция открыта Р. Фиттигом в 1855. Часто с хорошим выходом образуются
алканы с использованием реактива Гриньяра, например:

Несимметричные предельные углеводороды получают, используя медьорганическое
соединение:
Реакцию, подобную ВЮРЦА РЕАКЦИЯ р., используют для синтеза элементоорганическое соединение и бициклический
соединение, например:

Химическая энциклопедия. Том 1 >>
РЕАКЦИЯ ВЮРЦА – химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды. Сама реакция Вюрца заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K: 2RHal + 2Na = R–R + 2NaHal.Иногда ее трактуют как взаимодействие RNa или RLi с R"Hal.
Реакция была открыта французским химиком-органиком Шарлем Вюрцем (Wurtz Charles (1817–1884) в 1855 при попытке получения этилнатрия из хлористого этила и металлического натрия. Несмотря на то, что реакция Вюрца приводит к образованию новой углерод-углеродной связи, она нечасто применяется в органическом синтезе. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы, и, как видно из приведенной схемы, для получения заданного углеводорода следует брать только один алкилгалогенид, так как при конденсации двух алкилгалогенидов получается смесь всех трех возможных продуктов сочетания.
Поэтому если используется алкилгалогенид и натрий, реакцией Вюрца можно получить только углеводороды с четным количеством атомов углерода. Наиболее успешно реакция Вюрца протекает с первичными алкилйодидами. Очень низкие выходы целевого продукта получают при использовании метода Вюрца для вторичных алкилгалогенидов. Реакцию обычно проводят в диэтиловом эфире. Использование углеводородов в качестве растворителей уменьшает селективность реакции.
Однако если использовать заранее приготовленное металлоорганическое соединение, например алкиллитий, то можно получить и несимметричные продукты конденсации:
RLi + R"Hal = R – R" + LiHal
В обоих случаях реакция сопровождается образованием большого количества побочных продуктов за счет побочных процессов. Это иллюстрирует пример взаимодействия этиллития с 2-бромоктаном:
.
В этом случае 3-метилнонан и ряд побочных продуктов в указанных молярных соотношениях образуются как продукт реакции Вюрца.
Кроме натрия, в реакции Вюрца использовались такие металлы, как серебро, цинк, железо, медь и индий.
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций для построения карбоциклических систем. Так из 1,3-дибромпропана под действием металлического цинка и йодида натрия (в качестве промотора реакции) может быть получен циклопропан:

Можно построить и другие напряженные карбоциклические системы. Например, из 1,3-дибромадамантана, используя натрий-калиевый сплав, может быть получен 1,3-дегидроадамантан:
 .
.А взаимодействие 1-бром-3-хлор-циклобутана с натрием приводит к бициклобутану:
 .
.Известен ряд разновидностей реакции Вюрца, получивших свои собственные названия. Это реакция Вюрца – Фиттига и реакция Ульмана . Первая заключается в конденсации алкил- и арилгалогенида под действием натрия с образованием алкилароматического производного. В случае реакции Ульмана в конденсацию обычно вводят арилйодиды, а вместо натрия используют свежеприготовленную медь, эта реакция позволяет с высоким выходом получать различные биарильные производные, в том числе, и несимметричные, содержащие заместитель в одном из ароматических ядер:
 .
.Как полагают, механизм реакции Вюрца состоит из двух основных стадий:
1) образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na = R–Na + NaHal,
2) взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na = RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Источники: ресурсы Интернет
http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/REAKTSIYA_VYURTSA.html